● 臨床研究法について
● 臨床研究法に基づき実施する「臨床研究」とは
● 臨床研究法に従う研究を実施される方からのよくある質問(Q&A)
● 臨床研究を実施される方へ「やることリスト」
● 臨床研究の流れについて
● 研究者の教育について
臨床研究法について
「臨床研究法」は平成29年(2017年)4月14日に公布され、平成30年(2018年)4月1日に施行されました。
その目的は、臨床研究の実施の手続、認定臨床研究審査委員会による審査意見業務の適切な実施のための措置、臨床研究に関する資金等の提供に関する情報の公表の制度等を定めることにより、臨床研究の対象者をはじめとする国民の臨床研究に対する信頼の確保を図ることを通じてその実施を推進し、もって保健衛生の向上に寄与することです。
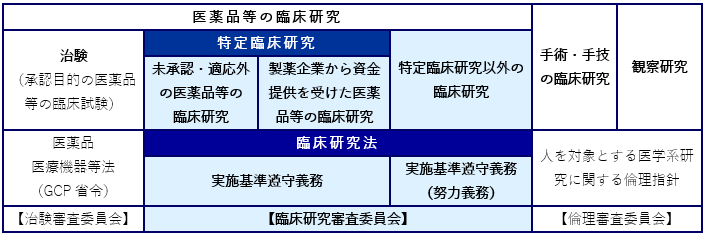
臨床研究法に基づき実施する「臨床研究」とは
※「医薬品等を人に対して用いる」とは、医薬品、医療機器又は再生医療等製品を人に対して投与又は使用する行
為のうち、医行為(*)に該当するものを行うことを指します。
*医行為:医師の医学的判断及び技術をもってするのでなければ人体に危害を及ぼし、又は及ぼすおそれのある行為
※「当該医薬品等の有効性又は安全性を明らかにする研究」とは、当該医薬品等の有効性又は安全性を明らかにす
る目的で、医薬品等を人に対して投与又は使用すること(医行為に該当するもの)により行う研究を言います。
※「適応外の医薬品・医療機器」とは、「添付文書に記載されている効能・効果、用法・用量と異なる使い方」で
実施する臨床研究が該当します。
*異なる使い方とは:例えば、添付文書に「3週投与1週休薬を1クール」と記載されているレジメンを、「2週投与1週休薬を1クー
ル」としたレジメンに変更して研究する場合や、「○○との併用で使用する」と添付文書に記載されているレジメンを、「△×と
の併用で使用する」とし添付文書の記載と異なる方法で使用する場合など。
※「研究資金等の提供を受けて実施する」研究の場合、資金提供を受ける前・研究実施前に、医薬品等製造販売業
者等との契約の締結が必要です。
厚生労働省 特定臨床研究の該当性に関するチェックリストはこちら
臨床研究法に従う研究を実施される方からのよくある質問
(臨床研究該当性)
(答)含まれる。
(答)該当する。
(答)該当しない。
(答)「食品」として販売されている物又はその成分を含有する物であっても、疾病の治療等に使用されることが目的とされている場合には「医薬品」に該当する。このため、これを患者等に投与することにより、疾病の治療等に対する有効性や安全性を評価することを目的とした研究は、未承認の医薬品を用いた臨床研究として、法の対象となる臨床研究に該当する可能性がある。
(特定臨床研究該当性)
(答)該当する。
(研究資金等)
(答)含まれない。
※臨床研究法における研究かどうか判断に迷う場合は、臨床研究開発センターまでご相談ください。
※研究相談はこちら
臨床研究を実施される方へ「やることリスト」(学内のみ閲覧可)
臨床研究の流れについて(学内のみ閲覧可)
研究者の教育について
研究責任医師及び研究分担医師は、臨床研究の対象となる疾患及び当該疾患に関連する分野について、
十分な科学的知見並びに医療に関する経験及び知識を有し、かつ、臨床研究に関連する倫理に配慮して
当該臨床研究を適正に実施するための十分な教育及び訓練を受けていなければならない。
臨床研究法では、臨床研究の実施に必要な知識についての講習、教育を受けることが求められています。
毎年、厚生労働省のホームページで研究会の案内が周知されています。
◇厚生労働省・臨床研究中核病院が実施する研修について(2025年度)はこちらから
◇臨床研究・治験従事者研修(令和7年度)のご案内はこちらから

